Tout sur l'osmium

Osmium - un métal rare, appartient au groupe du platine. Il a été découvert en Angleterre à la suite d'expériences sur la réaction du platine. Le nom osmium est donné en grec et en traduction signifie « odeur ». A quoi ressemble ce métal noble ? Quelles sont ses caractéristiques et quelle est son utilisation ?

Histoire
La découverte de cet élément s'est produite par accident en 1803 par les chimistes anglais Smithson Tennant et William H. Wollastan. À la suite d'expériences sur la réaction du platine à un mélange d'acides (sulfurique et nitrique), le précipité résultant a développé un arôme désagréable, rappelant la puanteur du chlore et du radis pourri. Des expériences similaires ont été menées par Colle-Descoti, Antoine de Fourcoy et Vauquelin en France. À la suite de leurs recherches, ils ont également trouvé une substance inconnue dans les sédiments insolubles du platine.



La substance alors inconnue s'appelait poussin, mais les expériences des Britanniques ont prouvé qu'il s'agissait de deux substances similaires - l'iridium et l'osmium.
La découverte de ces éléments chimiques a été présentée à la Royal Society de Londres par une communication écrite de Tennant datée du 21 juin 1804. Dans le tableau périodique des éléments chimiques de Mendeleev, le métal est situé sous le nombre ordinal 76. Le métal ne se présente pas sous sa forme pure par pépites, donc sa formule chimique est présentée sous forme dissoute.


L'élément est extrait de matières premières secondaires en raison de sa séparation des minerais d'iridium, de platine, de platine-palladium ou de cuivre et de nickel. La production annuelle de l'élément entier dans le monde ne dépasse pas la taille de 1 tonne.


Lieu de naissance
Les plus grands gisements du monde méritent d'être signalés, des zones telles que montagnes de l'Oural et Sibérie en Russie, état du nord Alaska et l'état de l'ouest Californie en Amérique, Canada en Amérique du Nord, Colombie en Amérique du Sud et certains Pays d'Afrique du Sud, Australie, Île Tasmanie... Actuellement, un gisement important d'osmium est considéré Complexe Bushwell en Afrique du Sud, la majeure partie de la substance y est extraite. Compte tenu du fait que les plus grands gisements de métal se trouvent en Afrique du Sud, les prix mondiaux de ce métal des terres rares sont assez élevés. Kazakhstan est considéré comme le seul grand exportateur d'osmium-187 au monde. Bien que la Chine possède des réserves de minerai de platine, elle n'a pas de quantités importantes d'osmium.


La substance est stockée sous forme de poudre et comme elle ne fond pas sous forme de cristaux, il n'est pas possible d'y apposer un tampon en raison de ses propriétés physiques. Pour la fabrication de lingots de ce métal, un chauffage par faisceau d'électrons ou à l'arc à partir d'une poudre est utilisé ; le chauffage dans un creuset est également utilisé.


Propriétés
L'osmium ressemble à un métal bleuté argenté. C'est l'un des éléments les plus denses, sa densité est de 22 600 kilogrammes par mètre cube, mais en même temps, la substance est assez fragile, se brise et s'effrite facilement. Il a une densité élevée et est capable de briller même sous des influences de température assez élevées. En raison de ses paramètres et de sa température de fusion importante, il est difficile à usiner. Dans la nature, il existe sous forme de sept isotopes, dont six sont considérés comme stables, à savoir l'osmium-184, l'osmium-187, l'osmium-188, l'osmium-189, l'osmium-190 et l'osmium-192. Des isotopes de métaux radioactifs avec des nombres de masse de 162 à 197 ont été obtenus en laboratoire, et certains isomères nucléaires ont également été obtenus artificiellement.
L'osmium, par ses caractéristiques, affecte négativement tous les organismes vivants.

Presque tous les composés avec ce métal causent des dommages aux organes internes, des troubles visuels et auditifs. En cas d'intoxication aux vapeurs d'osmium, des troubles irréversibles dans l'organisme et la mort peuvent survenir. Les scientifiques ont mené des expériences sur des animaux, dont les résultats ont été le développement rapide de l'anémie, l'absence de fonction pulmonaire normale. Il a été conclu qu'il s'agit d'un œdème qui se développe rapidement. Le tétroxyde d'osmium, utilisé en médecine, est une substance très corrosive. A l'odeur la plus désagréable du monde. En cas d'intoxication, la peau souffre, elle vire au vert ou au noir, souvent accompagnée d'ulcères et de crevasses, qui mettront très longtemps à cicatriser.

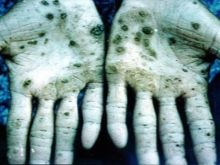

Les employés des installations de production sont les plus à risque ; selon toutes les normes de sécurité, ils ne travaillent que dans des respirateurs et des vêtements spéciaux. Tous les conteneurs contenant de l'oxyde d'osmium sont scellés et stockés conformément aux règles. Pour obtenir les minéraux de nevyanskite, le platine est converti en solution au moyen d'eau régale. Ensuite, le précipité résultant est exposé au zinc en une quantité 8 fois supérieure - un tel alliage est relativement facilement converti en un état pulvérulent, qui est ensuite fusionné avec du peroxyde de baryum. L'étape suivante est le traitement de la masse résultante avec de l'eau régale, la distillation à travers l'appareil de séparation du tétroxyde d'osmium.

En agissant sur la substance avec une solution alcaline, on obtient du sel. La solution saline est affectée hyposulfite, à la suite de quoi, à l'aide de chlorure d'ammonium, le métal précipite déjà sous forme de sel de Fremy. Le précipité est lavé, filtré et calciné. Le résultat de toutes ces actions est l'osmium spongieux. Par la suite, il est nettoyé avec des acides, réduit dans un four électrique sous un courant d'hydrogène et refroidi. Donc obtenez des échantillons d'osmium jusqu'à 99,9%.


Chimique
Les propriétés de cet élément, du point de vue de la chimie, sont étonnantes. Les plus élémentaires d'entre eux sont les suivants.
- L'osmium ne réagit pas du tout avec les alcalis et les acides. Forme des osmates solubles dans l'eau en réaction avec les fontes alcalines. L'interaction avec un mélange d'acides nitrique et chlorhydrique donne une réaction extrêmement lente.
- Très toxique, même à doses microscopiques. L'oxyde d'osmium, qui est libéré du platine, est particulièrement toxique.
- Il est impossible de déterminer le point d'ébullition du métal, car il est particulièrement réfractaire.
- Le métal contenu dans la poudre entre facilement dans une réaction de chauffage avec de telles substances : oxygène pur, halogènes, acides sulfurique ou nitrique.
- Dans divers composés, des nombres d'oxydes de -2 à +8 sont obtenus. Les plus courants sont +2, +3, +4 et +8.
- Capable de former des composés en grappes.
- Les principaux minéraux sont liés aux solutions solides et sont représentés par des alliages d'iridium avec de l'osmium - ce sont la sysertskite et la nevyanskite. De plus, la syserskite a un nom différent - l'osmium iridieux et la nevyanskite - l'iridium osmous.

Physique
Densité l'osmium est d'environ 22,61 grammes par centimètre cube. Les cristaux ont un bel éclat argenté, avec différentes nuances du gris au bleu. Dans les lingots, une couleur bleu foncé apparaît, dans la poudre elle est violette. Tout le métal a un éclat argenté. La toxicité de l'élément empêche son utilisation dans l'industrie de la bijouterie. Les principales propriétés physiques sont les suivantes.
- Le point de fusion de cet élément est assez élevé, la fusion est possible à des températures supérieures à 3000 degrés Celsius.
- Le métal n'a pas de propriétés magnétiques.
- Fermeté étonnante. Les alliages avec l'ajout de ce métal acquièrent une résistance à l'usure, une durabilité, une résistance à la corrosion et une résistance aux contraintes mécaniques accrues.
- Le point d'ébullition est de 5012 ºC.
- La dureté de Mohs est de 7.
- La dureté Vickers est de 3-4 GPa.

Applications
En raison du coût important de l'élément lui-même, ce métal est rarement utilisé dans la production industrielle de masse. L'osmium est principalement utilisé dans l'industrie chimique, où il est utilisé comme catalyseur. Le tétroxyde d'osmium est utilisé dans certains médicaments. Dans les analyses de laboratoire, il est utilisé pour la coloration des tissus vivants, assure la préservation de la structure cellulaire.
Dans l'industrie aérospatiale, l'osmium est utilisé dans l'équipement électronique des équipements pour l'aviation et la technologie des fusées, ainsi que dans la fabrication armes nucléaires. En raison du manque de propriétés magnétiques, le métal est utilisé dans la fabrication de montres de marque telles que Rolex. L'alliage osmium avec platine est utilisé lorsque création d'implants chirurgicaux Sont des stimulateurs cardiaques ou des valves pulmonaires.
De plus, l'osmium est utilisé en microscopie et pour créer des instruments de haute précision.



Faits intéressants
- Sous une pression d'environ 770 GPa dans l'osmium, les électrons interagissent dans des orbitales internes, la structure de la substance reste inchangée.
- Osmium dans les roches contient un demi pour cent de la masse totale des gisements de minerai.
- En raison de la haute densité l'apparence et le poids réel du métal varient considérablement. Ainsi, une bouteille en plastique de 0,5 litre remplie de cette poudre métallique sera plus lourde qu'un seau de 10 litres rempli d'eau.
- Ce métal est dans les cinq plus cher.
- Le coût d'une triple once d'osmium est un secret commercial, dans les sources ouvertes, vous pouvez trouver un prix approximatif pour 1 gramme d'une substance.
- En raison du caractère réfractaire de l'osmium noté dans l'histoire de la lampe électrique. Le scientifique allemand K. Auer von Welsbach a proposé de remplacer le filament de carbone d'une ampoule par un filament d'osmium. Les ampoules se sont avérées 3 fois moins énergivores et l'éclairage s'est nettement amélioré. Certes, il a rapidement été remplacé par le tantale plus courant, qui, à son tour, a été remplacé par du tungstène.
- Une situation similaire s'est produite avec le métal rare dans la production d'ammoniac. La méthode de synthèse de l'ammoniac, encore utilisée aujourd'hui, mise au point en 1908 par le chimiste allemand Fritz Haber, est impossible sans l'utilisation de catalyseurs.Initialement, les catalyseurs utilisés à cette époque ne montraient leurs propriétés qu'en présence de conditions de température importantes et n'avaient pas une efficacité élevée, de sorte que la recherche d'un remplacement était très urgente. Des scientifiques du laboratoire de l'École technique supérieure de Karlsruhe ont proposé d'utiliser de l'osmium finement atomisé comme élément catalytique. Les résultats des tests ont confirmé que cette idée est valable, la température catalytique a baissé de plus de 100 ºC et la libération d'ammoniac a considérablement augmenté. Certes, à l'avenir, ils ont refusé de l'osmium, mais il a aidé à résoudre un problème aussi important.

L'osmium et d'autres métaux rares et uniques jouent rôle important dans diverses industries... Même avec toute sa toxicité, il sauve des vies et la santé des gens.
Pour plus d'informations sur l'osmium, voir la vidéo suivante.








